医療機器・医療機器プログラム
「医療機器」とは「人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等」と定義されている。2014年の薬事法の改正で成立した「薬機法(正式名称:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)」で、デジタル技術等の発展にあわせ医療機器の定義が整理、拡充された。具体的には、従来、有体物の医療機器の中で動作するプログラムだけを規制対象としていたが、単体で動作する無体物のプログラムも「医療機器プログラム」と定義し、独立した規制対象とした。なお同法ではさらに、特に日本での技術開発が著しいiPS細胞などの再生医療用品を「再生医療等製品」として認め、これも単体の独立した規制対象としている。
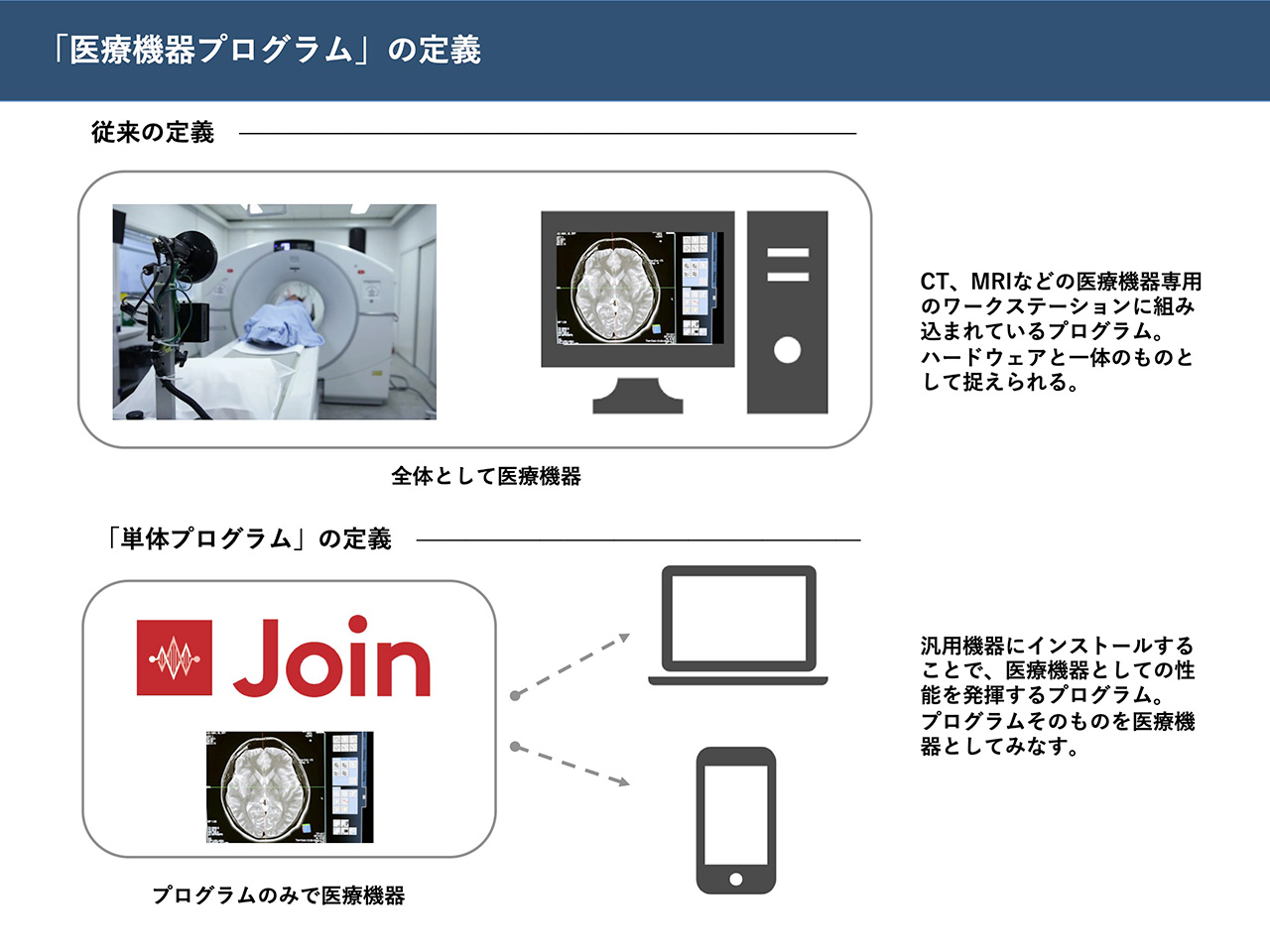
このように薬機法の成立により「医療機器」「医療機器プログラム」はそれぞれ独立した規制対象として正式に分立することになり、デジタル技術を活用したハードウェアだけでなく、ソフトウェアも薬事承認、保険適用される道が開かれた。

医療機器はその侵襲性の度合い、身体へ危険を及ぼすリスクに応じてクラスIからIVまで分類されているが、医療機器プログラムについても基本的にその分類を踏襲しつつ、ハードウェアにおいてクラスI(一般医療機器)に相当するプログラムは審査対象としない方針が示されている(平成28年3月31日付の厚生労働省発出の事務連絡)。
医療機器プログラム(SaMD)
「人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等」のうち、プログラム単体で動作するソフトウェアで、かつ薬機法で規制対象とされているもの。医療、予防用途で使われるプログラムは医療機器に組み込まれているものを含め多種多様あるが、薬事規制の対象となるものは、政令で定められている医療機器のクラス分類のうち、II以上のものとされている(平成28年3月31日付の厚生労働省発出の事務連絡)。 なお、この医療機器プログラムの別称として「SaMD(Software as a Medical Device)」が近年よく使われる。厚生労働省、内閣府での各種会議資料でもこの呼称が使われている。
医療機器が上市されるまで
1.規制対象の医療機器、医療機器プログラム

医療機器はその侵襲性、ヒトや動物に対するリスクの度合いに応じクラスIからIVまで分類され、クラス別に審査基準、審査機関、審査プロセスが分かれている。さらにハードウェアと「医療機器プログラム(単体で動作するソフトウェア)」は、分類は同じだが、規制の範囲そのものが変わってくる。具体的には、医療機器プログラムについては、クラスIに相当するもの(一般医療機器)は規制対象とはならない(平成28年3月31日付の厚生労働省発出の事務連絡)。
このように医療機器プログラムについては、ハードウェアと規制範囲が異なるため、開発中のものが規制の対象となるかどうか、メーカーが判断しやすいようにガイドラインが厚生労働省から出されている(令和3年3月31日付事務連絡)。
https://www.pmda.go.jp/files/000240233.pdf
2.薬事承認
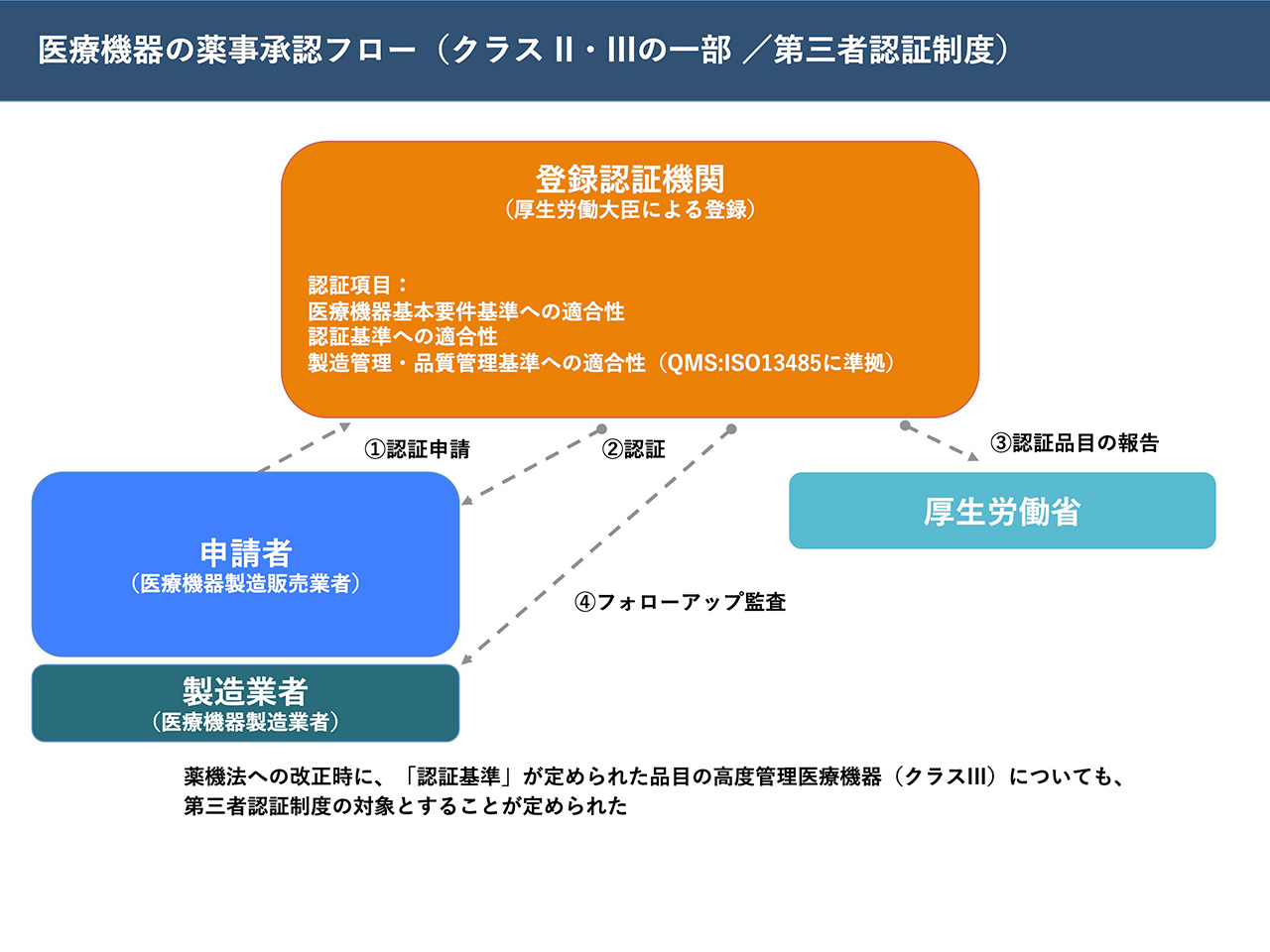
前提として、医療機器を製造販売する企業は「医療機器製造販売業」の許可を得る必要がある。取り扱う医療機器のクラスによってさらに種別が分かれており、その種別によって届出先や許可をえる当局が違ってくる。
製品に関しても同様に、分類されるクラスによって承認のプロセスが変わる。まずクラスI(一般医療機器)は審査承認を担当する機関である医薬品医療機器総合機構(PMDA)へ届出すれば販売が可能となる。クラスII(管理医療機器)については、政府が登録した第三者の企業・団体が認証を行う。クラスIII・IVについては、PMDAへ承認申請を行い、個別の審査を経る必要がある。
薬事承認の要件や審査内容、基準に対しては、厚生労働省が作成したガイダンス文書が公表されており、審査機関にも同じものが共有されている(平成28年3月31日付事務連絡)
http://www.jaame.or.jp/mdsi/program-files/280331guidance.pdf
3.保険適用プロセス
薬事認可を受けた医療機器、医療機器プログラムは、その後保険適用を受けたい場合、以下のプロセスを経なければならない。
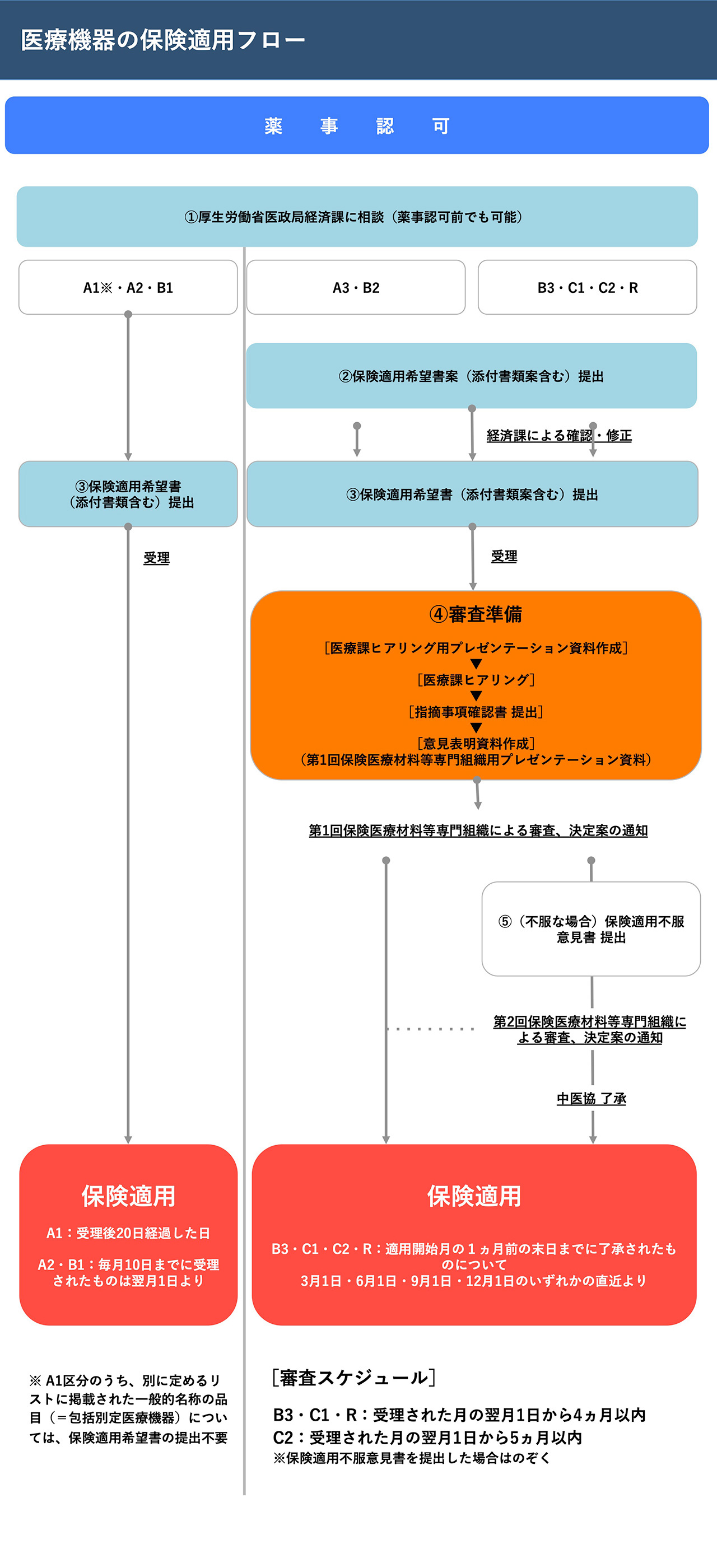
(出典)令和2年度 厚生労働省医政局経済課 委託事業 医療機器・体外診断用医薬品の保険適用に関するガイドブック/令和2年2月7日 医療機器の保険適用等に関する取扱いについてより
保険適用とはつまり、公的医療保険でまかない、広く普及させるに値すると認めることであるので、適用を受けるためには純粋に医療技術として有効であることを示すだけでなく、経済性、わかりやすく言えばコストパフォーマンスも証明する必要がある。保険適用した結果医療費が過度に増大し、医療保険財政に悪影響を与えるのでは本末転倒だからである。しかし、保険償還価格に関しては単に安く認めるということではなく、原価や対象となる疾患の患者の多寡(市場性)など、様々な要素を総合的に勘案して決定される。
保険適用を受けたい場合は、厚生労働省医政局経済課など※に事前に相談し、どの「保険医療材料区分」とするかメーカーで決めてから申請を行うことになる。現在の区分は以下のようになっており、新規に適用価格を定めてもらいたい場合はB、C、Rの区分で申請することが必要である。

なお厚生労働省が民間企業に委託し作成、公開した「医療機器・体外診断用医薬品の保険適用に関するガイドブック」https://www.mhlw.go.jp/content/10800000/000772964.pdf には、診療報酬制度のあらましと保険医療材料価格の決定に必要な「基準価格」の算定方法なども記載されている。
[補足]※令和3年度の規制改革推進会議で示された方針に基づき「プログラム医療機器(SaMD)」審査体制の強化と迅速化を図るため、厚生労働省はSaMDに関するワンストップの相談窓口をPMDAに設置した。厚生労働省医政局経済課も引き続き、保険適用に関して相談を受け付ける。
参考:SaMD 一元的相談窓口(医療機器プログラム総合相談)
https://www.pmda.go.jp/review-services/f2f-pre/strategies/0011.html
